unidad 8
Compuestos nitrogenados
Los compuestos nitrogenados son aquellos que contienen
nitrógeno en sus grupos funcionales. Los más destacados son las aminas y las
amidas.
- Amidas
Son compuestos que derivan
de los ácidos carboxílicos al sustituir el grupo -OH por el grupo amino (-NH3).
Se nombran sustituyendo la terminación -oico del ácido por -amida.
- Generalidades de amidas
A temperatura ambiente son sólidas, excepto la metanamida que es líquida
Tienen temperaturas de ebullición altas.
Las amidas con pocos átomos de carbono son solubles en agua.
Las amidas son compuestos orgánicos cuyo grupo funcional es -CONH2.
Las amidas son derivados
funcionales de los ácidos carboxílicos, en los que se ha sustituido el grupo
—OH por el grupo —NH2, —NHR o —NRR', con lo que resultan, respectivamente, las
llamadas amidas primarias, secundarias o terciarias, que también se llaman
amidas sencillas, N-sustituidas o N-disustituidas.
- Nomenclatura de amidas
Regla 1. Las amidas se
nombran como derivados de ácidos carboxílicos sustituyendo la terminación -oico
del ácido por -amida.
Regla 2. Las amidas son grupos prioritarios frente a aminas, alcoholes, cetonas, aldehídos y nitrilos
Regla 3. Las amidas actúan
como sustituyentes cuando en la molécula hay grupos prioritarios, en este caso
preceden el nombre de la cadena principal y se nombran como carbamoíl...
Regla 4. Cuando el grupo amida va unido a un ciclo, se nombra el ciclo como cadena principal y se emplea la terminación -carboxamida para nombrar la amida
- Ejercicios de nomenclatura de amidas
- propiedades y reactividad de amidas
Pueden dividirse en amidas primarias, las cuales son sólidas y poseen un punto de fusión que es preciso. En secundarias, terciarias y existe también la formamida, que son liquidas, estas además pueden tener la particularidad de no ser incoloras e inodoras. Los puntos de ebullición y fusión son anormalmente altos.
Las amidas son las menos
reactivas de los derivados de ácidos carboxílicos porque la electrofilia del
carbono del grupo C=O. está muy disminuida por la cesión electrónica del nitrógeno.
La hidrólisis de una amida no suele ser fácil y requiere ácidos o bases fuertes
y altas temperaturas.
- Aminas
- Tienen carácter básico y reaccionan con los ácidos fuertes para formar sales
- Tiene olor similar al del pescado en descomposición
- Las aminas con pocos átomos de carbono son gaseosas
- Las aminas más pequeñas son solubles en agua, aunque a mayoría no lo son
- Las aminas son compuestos orgánicos que tienen el grupo funcional -NH2
Las aminas son compuestos muy polares. Las aminas primarias y secundarias pueden formar puentes de hidrógeno. Las aminas terciarias, sin puentes de hidrógeno, tienen puntos de ebullición más bajos que las aminas primarias y secundarias de pesos moleculares semejantes.
- Nomenclatura de aminas
Regla 1. Las aminas se
pueden nombrar como derivados de alquilaminas o alcanoaminas.
Regla 2. Si un radical está repetido varias veces, se indica con los prefijos di-, tri-Si la amina lleva radicales diferentes, se nombran alfabéticamente
Regla 3. Los sustituyentes unidos directamente al nitrógeno llevan el localizador N. Si en la molécula hay dos grupos amino sustituidos se emplea N,N'.
Regla 4. . Cuando la amina no es el grupo funcional pasa a nombrarse como amino-. La mayor parte de los grupos funcionales tienen prioridad sobre la amina (ácidos y derivados, carbonilos, alcoholes)
Las aminas presentan puntos
de fusión y ebullición más bajos que los alcoholes La menor electronegatividad
del nitrógeno, comparada con la del oxígeno, hace que los puentes de hidrógeno
que forman las aminas sean más débiles que los formados por los alcoholes.
Una amina es un nucleófilo
una base de Lewis debido a que el par solitario de electrones no enlazantes
pueden formar un enlace con un electrófilo. Una amina también puede actuar como
base de Brönsted-Lowry, aceptando un protón de un ácido. Los grupos alquilo son
donantes de electrones.
- Nitrocompuestos
- Generalidades de nitrocompuestos
Los nitrocompuestos
aromáticos tienen pocos usos directos que no sean en la fabricación de
explosivos o como disolventes. su mayor consumo coresponde a los derivados de
la anilina en la fabricacion de
colorantes,pigmentos,insecticidas,textiles(poliamida resistene al calor)
plasticos,resinas,elastomeros.
- Nomenclatura de nitrocompuestos
Regla 1. Se nombran como
substituyentes del hidrocarburo del que proceden indicando con el prefijo
"nitro-" y un número localizador su posición en la cadena carbonada.
Regla 2. Las insaturaciones
tienen preferencia sobre el grupo nitro.
- Ejercicios de nomenclatura de nitrocompuestos
Los nitroderivados o nitrocompuestos
o compuestos nitro son compuestos orgánicos que contienen uno o más grupos
funcionales nitro (-NO2). Son a menudo altamente explosivos; impurezas varias o
una manipulación inapropiada pueden fácilmente desencadenar una descomposición
exotérmica violenta
- Nitrilos
- Generalidades de nitrilos
Nitrilos o cianuros. Son
sustancias en las que, en uno de los extremos de la cadena de carbono, hay un
triple enlace entre un átomo de carbono y un átomo de nitrógeno. El radical R
puede ser una cadena de carbono o un hidrógeno. Cuando el grupo R-CN no es el
grupo principal, se utiliza la palabra ciano para designarlo.
Los nitrilos se obtienen por
acción del cianuro de sodio o de potasio sobre los haluros de alquilo, y
también calentando las amidas en presencia de un deshidratante.
- Nomenclatura de Nitrilos
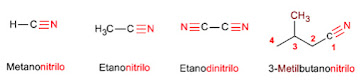
Regla 1. La IUPAC nombra los
nitrilos añadiendo el sufijo -nitrilo al nombre del alcano con igual número de
carbonos.
Regla 2. Cuando actúan como sustituyentes se emplea la partícula ciano. precediendo el nombre de la cadena principal
Regla 3. Los nitrilos unidos
a ciclos se nombran terminando el nombre del anillo en -carbonitrilo
La gran polaridad del enlace
CN provoca que los nitrilos tengan puntos de ebullición bastante elevados en
relación con su peso molecular. Asimismo, son buenos disolventes de compuestos
orgánicos polares, como ácidos carboxílicos, aldehídos y cetonas, etc., siendo
a su vez relativamente solubles en agua.
Los nitrilos sufren
reacciones de adición de nucleófilos, mediante un mecanismo que podemos
denominar de "doble adición-eliminación". La hidrólisis de un nitrilo
conduce a un acido carboxílico Alcoholisis
La reacción con alcoholes primarios conduce a ésteres.








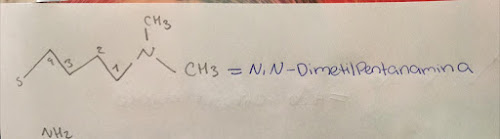













Comentarios
Publicar un comentario