unidad 9
Reacciones Orgánicas
- Factores que afectan la reactividad y propiedades físicas de los compuestos orgánicos.
Los compuestos orgánicos
poseen propiedades físicas características, que los diferencian notablemente de
los compuestos inorgánicos. Entre estas propiedades tenemos la densidad, las
temperaturas de ebullición y fusión y la solubilidad en agua. Los valores de
densidad y puntos de fusión y ebullición en los compuestos orgánicos, son
bajos, si tomamos como referencia el agua, o los compuestos inorgánicos
Los compuestos orgánicos
puros frecuentemente tienen puntos de fusión, puntos de ebullición, olor,
color, índice de refracción, densidad, característicos. Estas propiedades
físicas sirven para identificar un compuesto determinado entre diversos
compuestos orgánicos conocidos
- Tipos de ruptura de enlaces (homolítica y heterolítica)
Ruptura Homolitica y Heterolitica. La energía involucrada en este proceso se denomina energía de disociación heterolítica de enlace. La apertura del enlace también es posible por un proceso denominado homólisis. En la heterólisis, se requiere energía adicional para separar el par iónico.
Homolitica: Se produce cuando cada átomo
que se separa retiene un electrón de los dos que constituyen el enlace, formando
radicales libres.
En química se denomina
homólisis o ruptura homolítica a la ruptura de un enlace químico en el que cada
átomo participante del enlace retiene un electrón del par que constituía la
unión formándose dos radicales.
La energía necesaria para llevar a cabo la ruptura se conoce como "energía de disociación homolítica de enlace" y puede ser aportada, por ejemplo, por medio de radiación ultravioleta
Otros tipos de ruptura de
enlace, como la heterólisis, implican que una de las especies formadas retiene
los dos electrones que formaban parte de la unión, quedando con una carga
eléctrica neta negativa mientras la otra especie queda con una carga positiva.
Las reacciones Homilisis de divide en dos:
- Radical libre: Los radicales libres son átomos o grupos que tienen un electrón (e-) por lo que son muy reactivos
- Reacciones radicales: En ellas intervienen radicales, generalmente como estados intermedios. Estas reacciones se divide en tres fases: iniciación, propagación y terminación
Heterolitica: En química se denomina heterólisis o ruptura heterolítica a la ruptura de un enlace químico de una molécula neutral que genera un catión y un anión. En este proceso, los dos electrones que constituyen el enlace son asignados al mismo fragmento. es uno de los grupos en que se divide la molécula se lleva los dos electrones. Este tipo de ruptura da lugar a los carbocationes y carbaniones
Consiste en la interacción eléctrica de especies ionicas solventadas o disueltas. Ocurre generalmente en una disolución acuosa y corresponde a la mayoría de las reacciones en laboratorio . Uno de los átomos separados se lleva los dos electrones que constituían el enlace, formándose un anión y un catión.
La ruptura heterolítica en un enlace covalente tiende a producirse en moléculas con una gran polaridad. Esta ruptura tiene lugar en condiciones más suaves que la ruptura homolítica, y por lo general, se da en presencia de disolventes polares que consiguen estabilizar a los iones.
- Tipos de iones orgánicos (carbocatión y carbanión)
Existen diferentes tipos de carbocationes: primarios, secundarios, terciarios, vinílicos, arílicos, bencílicos, entre otros.
- En un carbocatión primario (1o) el carbono que tiene la carga positiva sólo esta unido a un grupo alquilo.
- En un carbocatión secundario (2o) el carbono con carga positiva está unido a dos grupos alquilo que pueden ser iguales o diferentes.
- En un carbocatión terciario el átomo de carbono positivo está unido a tres grupos alquilo que puede ser cualquier combinación de grupos alquilo o arilo iguales o diferentes.
Efecto de resonancia: Cuando la carga positiva de un carbocatión se distribuye entre varios átomos debido a la presencia de un doble enlace, un átomo que tenga pares de electrones no compartidos o un anillo aromático vecinos, la carga se estabiliza. Este efecto se denomina efecto de resonancia, y es común en compuestos aromáticos, éteres o carbocationes alílicos como se ve en la siguiente figura.
Estabilidad de los
carbocationes:
Transposición: Otra forma de estabilizar una carga positiva es mediante una transposición que consiste en que un átomo o grupo de átomos vecinos al carbocatión, se transfiera al carbocatión junto con sus electrones de enlace, para dejar una carga positiva más estable, por ejemplo en un carbocation propilo donde la carga positiva está en el carbono primario, un hidrógeno del carbono vecino se transfiere al carbocatión para formar el carbocatión sobre un carbono secundario que es más estable.
Los carbianones son aniones iones
del átomo de carbono que se obtienen por rotura heterolítica disimétrica de un
enlace químico.
Se originan en reacciones ácido-base, en las que el compuesto orgánico actúa como ácido protónico.
En general, son poco
estables por la acumulación de carga negativa, por lo tanto son bases fuertes.
La facilidad de formación de los carbaniones y en cierta manera, la estabilidad
relativa de los mismos, se puede evaluar considerando la fortaleza de los
ácidos conjugados correspondientes, ya que cuanto más débiles sean más
difícilmente formarán el correspondiente carbanión, que resultará menos
estable.
propiedades: Un carbanión, dada su carga negativa, es un nucleófilo. Por tanto al reaccionar con carbonos electrófilos formará nuevos enlaces C-C. Un carbanión es un importante intermedio de reacción. Lo podemos encontrar por ejemplo en la reacción de Michael o en la química organometálica en la reacción de Grignard o en los compuestos de alquil-litio (u organolíticos).
- Tipos de reactivos orgánicos (nucleofilo, electrófilo y radicales libres)
nucleofilo: Un reactivo nucleófilo es una sustancia “ávida” de núcleos. Posee un átomo rico en electrones y puede formar un enlace donando un par de electrones a un átomo con deficiencia en electrones. Los nucleófilos pueden tener carga neutra o negativa.
En química un nucleófilo es una especie que reacciona cediendo un par de electrones libres a otra especie (el electrófilo), combinándose y enlazándose covalentemente con ella. Los nucleofilos ambidentados son aquellos que tienen dos posibles centros de reacción.
Los mejores nucleófilos están a la izquierda en la tabla periódica ya que aumenta la basicidad en esta dirección. Ejemplos: NH3 mejor nucleófilo que H2O. PH3 mejor nucleófilo que H2S
Un electrófilo es toda
aquella especie química (átomo o molécula) que busca ávidamente un par de
electrones. La palabra quiere decir ‘amor por los electrones’. Por lo tanto, un
electrófilo siempre tenderá a ganar o aceptar electrones cuando participa en
las reacciones químicas.
reacciones: Los electrófilos reaccionan aceptando pares de electrones de átomos con altas densidades negativas, es decir, ricos en electrones. Estos átomos o moléculas negativas reciben el nombre de nucleófilos, Nu–, los cuales donan un par de electrones hacia el electrófilo E o E+
El nucleófilo no necesariamente tiene que tratarse de un anión, sino que puede también ser una molécula neutra con un átomo electronegativo, como el nitrógeno.
Los radicales libres son
moléculas inestables que perdieron un electrón y que buscarán reemplazarlo a
como dé lugar. Los radicales libres causan envejecimiento, alteraciones en el
ADN y enfermedades cardiovasculares, arterioesclerosis, diabetes, aumentan
niveles de colesterol malo y cáncer.
tipos de radicales:
- Radicales centrados en el nitrógeno: como el radical nitrato ·NO3
- Radicales centrados en el oxígeno: como el radical hidroxilo ·OH, muy reactivo.
- Radicales centrados en átomo de halógeno: como el radical cloro Cl·
- Radicales centrados en átomo de metal: como el radical •SnH3
- Introducción a tipos de reacciones.
Las reacciones químicas
suceden cuando se rompen o se forman enlaces químicos entre los átomos. Las
sustancias que participan en una reacción química se conocen como los
reactivos, y las sustancias que se producen al final de la reacción se conocen
como los productos.
Para que se produzca la
reacción es necesario que las moléculas de los reactantes choquen entre sí, ya
que es la única manera de que puedan intercambiar átomos para dar los
productos. Ésta es una condición necesaria pero no suficiente ya que el choque
debe darse con una mínima energía para que los enlaces de los reactivos se
puedan romper, y con la orientación que les permita unirse para formar las
moléculas de los reactivos. Si se dan todas las condiciones hablaremos de
choque efectivo.
Las reacciones químicas
(también llamadas cambios químicos o fenómenos químicos) son procesos
termodinámicos de transformación de la materia. En estas reacciones intervienen
dos o más sustancias (reactivos o reactantes), que cambian significativamente
en el proceso, y pueden consumir o liberar energía para generar dos o más
sustancias llamadas productos.
Toda reacción química somete a la materia a una transformación química, alterando su estructura y composición molecular (a diferencia de los cambios físicos que sólo afectan su forma o estado de agregación). Los cambios químicos generalmente producen sustancias nuevas, distintas de las que teníamos al principio
Las reacciones químicas
pueden darse de manera espontánea en la naturaleza (sin que intervenga el ser
humano), o también pueden ser generadas por el ser humano en un laboratorio
bajo condiciones controladas.
- Tipos de reacciones químicas
- Reacción de síntesis:
En este tipo de reacción dos o más compuestos reaccionan entre sí para formar un nuevo producto.
- Reacción de descomposición
En este tipo de reacción una
sustancia o compuesto se descomponen para formar dos o más productos.
- Reacción de precipitación
En este tipo de reacción que
ocurre en un medio acuoso, en la que uno de los productos es una sustancia poco
soluble y se deposita en forma sólida (precipita).
- Reacción de combustión
En este tipo de reacción los
reactivos son un combustible y el oxígeno del aire, y los productos generados
son dióxidos de carbono y agua.
- Reacción de sustitución o desplazamiento
En este tipo de reacción un
elemento desplaza a otro dentro de un compuesto químico.
- Reacción de doble sustitución o doble desplazamiento
En este tipo de reacción existe un intercambio de elementos de dos o más compuestos.















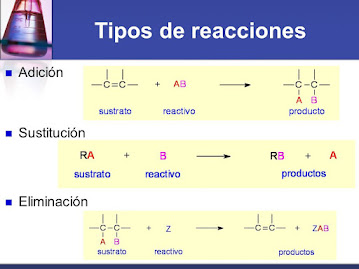


Puso reacciones de tipo inorgánicas no orgánica
ResponderEliminar